Le tableau d’avancement est enseigné dès la classe seconde en cours de physique-chimie. La maîtrise de cet outil permettant de quantifier les réactions chimiques demeure indispensable pour les lycéens de première et de terminale ayant choisi la spécialité physique-chimie.
Après un bref rappel théorique, nous allons détailler toutes les étapes de la construction du tableau d’avancement – de l’écriture de la réaction équilibrée jusqu’à l’état final – à l’aide d’un exemple classique d’une réaction de combustion.
À quoi sert le tableau d’avancement ?
En effet, une réaction chimique ne se déroule pas instantanément : elle évolue au cours du temps. Dans le tableau d’avancement, on ne met que les quantités effectivement présentes au moment considéré.
Les 6 étapes de la construction d’un tableau d’avancement
- On écrit l’équation de la réaction équilibrée.
- On remplit la ligne de l’état initial.
- On remplit la ligne de l’état intermédiaire.
- On remplit provisoirement la ligne de l’état final.
- On détermine l’avancement maximal et le réactif limitant.
- On revient dans le tableau pour compléter l’état final.
Exemple de tableau d’avancement : la combustion du méthane
Considérons la réaction de combustion du méthane par le dioxygène.
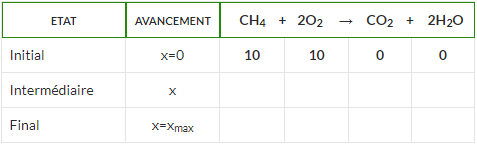
Admettons qu’il y ait au départ 10 moles de méthane et 10 moles de dioxygène. Ce sont ces quantités qui seront présentes dans le tableau à l’état initial.
1) On écrit l’équation de la réaction équilibrée
CH4 + 2O2 → CO2 + 2H2O
Dans cette réaction, les réactifs sont le méthane (CH4) et le dioxygène (O2). Et les produits sont le dioxyde de carbone (CO2) et l’eau (H2O).
2) On remplit la ligne de l’état initial
La première ligne du tableau indique les quantités de matière (en mol) présentes à l’état initial.
L’avancement x de la réaction est un nombre allant de 0 pour l’état initial, à xmax pour l’état final. On peut le voir comme un curseur pour mesurer – comme son nom l’indique – le degré d’avancement de la réaction.
L’avancement s’exprime en moles (mol).
- Quand x vaut 0, la réaction démarre.
- Quand x vaut xmax, elle se termine.
3) On remplit la ligne de l’état intermédiaire
Remarquez comment sont utilisés les coefficients stœchiométriques. En effet, comme 2 moles de O2 sont consommées pour une seule mole de méthane (CH4), le dioxygène (O2) sera logiquement consommé 2 fois plus vite.
Pour la même raison, il se crée deux fois plus de molécules d’eau (H2O) que de dioxyde de carbone (CO2).
Le tableau indique donc les quantités de réactifs et de produits présents pour l’avancement x.
4) On remplit provisoirement la ligne de l’état final
5) On détermine l’avancement maximal et on trouve le réactif limitant
La réaction va s’arrêter dès que l’un des deux réactifs aura disparu, c’est-à-dire dont la quantité de matière sera réduite à 0 mol. Celui qui disparaît en premier – que l’on appelle le réactif limitant – déterminera la valeur de xmax.
Pour cela on résout deux équations :
- 10-xmax = 0 ⇔ xmax = 10
- 10-2xmax = 0 ⇔ xmax = 5
Celle donnant la plus petite valeur nous fournit la valeur de xmax.
Donc xmax = 5 mol.
En effet, lorsque x=5, alors il n’y a plus de dioxygène : le dioxygène est le réactif limitant, celui qui arrête la réaction. En revanche il reste encore du méthane.
6) On revient dans le tableau et on complète l’état final
Nous avons donc trouvé la valeur de xmax qui va nous permettre de calculer toutes les espèces présentes en fin de réaction :
- nCH4 = 10-xmax = 10-5 = 5 mol
- nO2 = 10-2xmax = 10-2×5 = 0 mol
- nCO2 = xmax = 5 mol
- nH2O = 2xmax = 2×5 = 10 mol.
On reprécise donc la dernière ligne du tableau :
Questions fréquentes sur le tableau d’avancement
Pourquoi l’avancement maximal correspond-il au réactif limitant ?
L’avancement maximal correspond au moment où l’un des réactifs est totalement consommé. Ce réactif, appelé réactif limitant, impose l’arrêt de la réaction chimique : au-delà, il n’est plus possible de former de nouveaux produits.
Peut-on avoir deux réactifs limitants dans un tableau d’avancement ?
Cela ne peut se produire que si les deux réactifs sont dans des proportions stœchiométriques parfaites. Ils sont alors entièrement consommés en même temps.
Le tableau d’avancement est-il exigé à l’épreuve de spécialité physique-chimie du bac ?
Bien qu’il ne soit pas toujours explicitement demandé, le tableau d’avancement doit être utilisé dans les exercices de chimie faisant intervenir des réactions chimiques.
Tout est-il bien clair ? Sinon viens me retrouver pour un stage de physique-chimie lors des prochaines vacances. En attendant, n’hésite pas à poser tes questions en commentaires !
Je suis professeur de physique-chimie aux Cours Thierry depuis le début de leur existence. J’anime stages et cours hebdomadaires en petits groupes avec passion et dans un soucis constant de convivialité.





J’ai beaucoup aimé les explications simples et efficaces. Merci