La mole est une notion fondamentale en chimie, introduite dès la classe de seconde. Elle est encore très utilisée en spécialité physique-chimie en classes de 1ère et de Terminale. Elle permet de relier le monde microscopique des atomes et molécules aux quantités mesurables en laboratoire.
Sommaire
La physique-chimie au lycée est-elle un problème pour toi ? Nous serions heureux de pouvoir te venir en aide lors de nos stages de physique-chimie à Paris !
Comprendre la mole facilement : exemple de packs de bouteilles
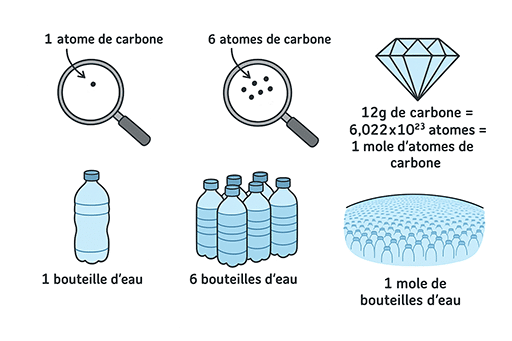
De la même manière que l’on peut compter les bouteilles d’eau par « packs » qui contiennent 6 bouteilles, un chimiste comptera également en packs les particules (atomes, molécules, etc.). La seule différence est que le pack est beaucoup plus gros puisqu’il contient 6,022×1023 particules au lieu des 6 bouteilles ! Ce nombre est appelé la constante d’Avogadro et se note Na :
Constante d’Avogadro :
Na = 6,022 × 1023
Une mole contient toujours
6,022 × 1023 entités (atomes, molécules, ions, etc.).
C’est un nombre énorme !
Na = 602 000 000 000 000 000 000 000 ou encore Na = 602 mille milliards de milliards !
Ainsi une mole de bouteilles d’eau contiendrait 602 mille milliards de milliards de bouteilles. A titre de comparaison, 89 milliards de bouteilles d’eau en plastique sont vendues chaque année dans le monde.
(Source : https://www.planetoscope.com/dechets/321-consommation-mondiale-de-bouteilles-d-eau-en-plastique.html).
Exercice d’application : calcul de la masse d’une mole d’atomes de carbone
1. Sachant que la masse d’eau dans une bouteille est 1,5 kg, calculer la masse d’eau contenue dans 10 packs de 6 bouteilles.
C’est trop facile, il suffit de calculer : 1,5×6×10 = 90 kg !
On utilise la même méthode en chimie mais avec des nombres moins parlants.
2. Sachant que la masse d’un nucléon est 1,67×10-27 kg, calculer la masse d’une mole d’atomes de Carbone 12.
Il faut savoir qu’un atome de carbone 12 contient 12 nucléons. Une fois cela compris, c’est très simple, on multiplie, comme pour les bouteilles d’eau :
m = 1,67×10-27×12×6,022×1023
m = 0,012 kg
m = 12 g
Une mole de carbone 12 pèse donc 12 g.
Définition de la mole
L’exemple ci-dessus nous permet d’introduire la définition de la mole : c’est le nombre d’atomes contenus dans 12 g de carbone 12.
La mole est la quantité de matière contenant autant d’entités élémentaires (atomes, molécules, ions, électrons…) qu’il y a d’atomes dans 12 g de 12C
soit Na = 6,022 × 1023 entités.
Dans la suite du programme, on se sert des moles, on compte en moles. Un peu comme si on vous demande d’acheter quelques packs de bouteilles d’eau sans savoir combien de bouteilles contient un pack…
La quantité de matière a pour unité la mole. Par exemple, à la question, quelle est la quantité de matière contenue dans 12 g de carbone, on répond : n = 1 mol.
Pourquoi un aussi grand nombre d’entités dans chaque mole ?
Le chimiste effectue les réactions chimique entre atomes et molécules qui sont des particules incroyablement petites et légères. Par exemple, pour faire une expérience avec 1g de carbone, il utilise 5×1022 atomes !
On a donc choisi Na de manière à pouvoir faire le lien entre le microscopique (inaccessible à la manipulation, c’est à dire chaque particule) et le mésoscopique (accessible à la manipulation, c’est à dire quelques grammes de particules).
La masse molaire
Molaire est tout simplement l’adjectif du mot mole. Autrement dit, quand on parle de masse molaire, on pourrait aussi bien parler de la masse d’une mole : cela signifie la même chose.
Dans le tableau périodique
La masse molaire d’un élément est donnée dans le tableau périodique des éléments, et aussi dans les consignes des exercices car on ne peut les connaître toutes par cœur ! Il est toutefois préférable de retenir les masses molaires des principaux atomes. Ci-dessous MC représente la masse molaire du Carbone, MH celle de l’Hydrogène, MO celle de l’Oxygène :
- MC = 12 g.mol-1
- MH = 1 g.mol-1
- MO = 16 g.mol-1
Sur le tableau périodique ci-dessous, découvre où se lit la masse molaire de chaque élément, dont la valeur est toujours proche de son nombre de nucléons :

Il s’agit là de masses molaires atomiques (masse molaire d’un atome). Pour calculer les masses molaires moléculaires (masse molaire d’une molécule), il suffit d’ajouter les masses molaires des atomes qui constituent la molécule.
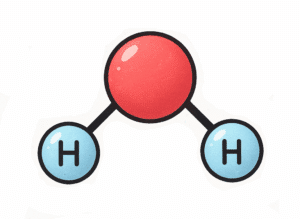
Exemple : calcul de la masse molaire de l’eau (H2O) :
MH2O = 2×MH+MO
MH2O = 2×1+16
MH2O = 18 g.mol-1
Ainsi une mole d’eau fait une masse de 18 g.
Comment utilise-t-on la masse molaire ?
On utilise très souvent la masse molaire pour effectuer des calculs en chimie.
La formule ci-dessous est la plus importante à connaître car elle sera utilisée tout au long du lycée, en seconde, ainsi qu’en spécialité physique-chimie en 1ère et en Terminale.
Formule reliant masse et quantité de matière
Voici la formule permettant de calculer la quantité de matière en connaissant la masse d’un composé :
Formule à retenir :
\mathbf{n=\frac{m}{M}}- n : quantité de matière (en mol)
- m : masse (en g)
- M : masse molaire (en g·mol-1)
Cette formule se décline en m=nM si c’est la masse qu’il faut calculer.
Ci-dessous deux petits exercices corrigés de niveau seconde pour illustrer ces formules.
Exercice corrigé pour trouver la quantité de matière
Nous disposons de 27 g d’eau. Quelle quantité de matière cela représente-t-il ?
- mH2O = 27 g
- MH2O = 18 g (calculée ci-dessus)
Nous cherchons nH2O
Utilisons la première formule : \mathbf{n_{\text{H}_2\text{O}} = \frac{m_{\text{H}_2\text{O}}}{M_{\text{H}_2\text{O}}}}
nH2O = 27 / 18
nH2O = 1,5 mol
Exercice corrigé pour trouver la masse
Une réaction de combustion nous permet de récupérer 0,5 mol d’eau. Quelle est la masse d’eau correspondante ?
- nH2O = 0,5 mol
- MH2O = 18 g
Utilisons la seconde formule : mH2O = nH2O × M H2O
mH2O = 0,5×18
mH2O = 9 g
FAQ sur la mole en chimie
À quoi sert la mole en chimie ?
La mole permet de relier le monde microscopique des atomes et molécules aux quantités mesurables en laboratoire. Elle sert notamment à équilibrer des réactions chimiques et à effectuer des calculs de masses et de quantités de matière.
Quelle est la masse molaire de l’eau (H2O) ?
La masse molaire de l’eau vaut 18 g·mol-1. Elle se calcule ainsi : MH2O = 2×MH + MO = 2×1 + 16 = 18 g·mol-1.
Comment calculer une quantité de matière ?
On utilise la formule n = m / M, où n est la quantité de matière (en mol), m la masse (en g) et M la masse molaire (en g·mol-1).
N’hésite pas à poser toutes autres questions en commentaires !
Je suis professeur de physique-chimie aux Cours Thierry depuis le début de leur existence. J’anime stages et cours hebdomadaires en petits groupes avec passion et dans un soucis constant de convivialité.
Besoin d’aide pour maîtriser la mole et les calculs en chimie ? Retrouve Thibaud à nos cours de soutien en physique-chimie à Paris !

Merci pour cette explication et demonstration
Oui, c’est vrai, c’est super bien expliqué !!
Franchement, ce cours est super bien expliqué, même avec humour !! Ce que je n’ai pas compris en une semaine, je l’ai compris là, en lisant seulement ce cours !! De plus, ce n’est pas très long, donc on peut facilement le lire dans le bus, ou en faire une fiche !!
MERCI BEAUCOUP
Merci beaucoup de vos retours !!
Très bon cours je valide. J’ai eu 18/20 à mon bac blanc grâce a vous merci beaucoup. Je vous en suis infiniment reconnaissant !
Avec plaisir ! Merci de ton retour.